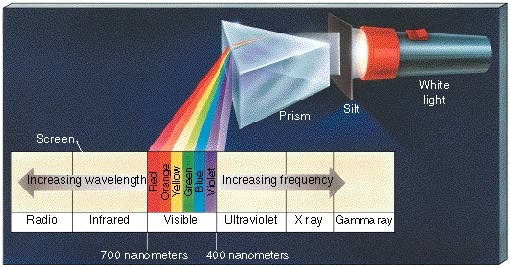
Pues bien, la luz que emiten los átomos de los elementos da lugar a espectros discontinuos:
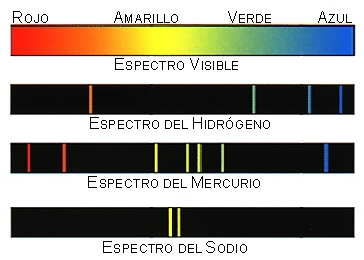
El hecho de que cada átomo tenga un espectro de rayas distinto y discontinuo debe estar relacionado con su estructura. Esto no se podía explicar con el modelo de Rutherford. Es ahí cuando prescindimos de la teoría de Bohr para evolucionar el modelo atómico.
Dependiendo del tipo de gas, la fuente luminosa y lo que arribe al detector, se pueden producir dos tipos de líneas: de emisión o de absorción. Si el gas se encuentra entre el detector y la fuente de luz —la cual, por lo general, se tratará de una fuente con espectro continuo—, de tal forma que el detector pueda observar el espectro tanto del gas como de la fuente, se observará una disminución de la intensidad de la luz en la frecuencia del fotón incidente, debido a que la mayor parte de los fotones reemitidos saldrán en direcciones diferentes a las que poseían los fotones originales. En este caso se observará una línea de absorción. Por otro lado, si el detector es capaz de observar el gas, pero no puede ver la fuente de luz, se observarán solamente los fotones reemitidos, resultando en líneas de emisión.
La posición de las líneas espectrales depende del átomo o molécula que las produzca. Debido a lo anterior, estas líneas son de gran utilidad para identificar la composición química de cualquier medio que permita pasar la luz a través de él. Varios elementos químicos se han descubierto gracias a la espectroscopia. Entre algunos de éstos están el helio, el talio y el cerio. Las líneas espectrales también dependen de las condiciones físicas del gas. Por esta razón, son comúnmente utilizadas para determinar las características físicas, además de la composición química, de estrellas y otros cuerpos celestes, para los cuales no existe ningún otro método de análisis.
Existen otros mecanismos de producción de líneas espectrales, además de las interacciones fotón-átomo. Dependiendo del tipo de interacciónfísica (entre moléculas, átomos, etc.), la frecuencia de los fotones resultantes puede ser muy diversa. Debido a esto, se pueden observar líneas en cualquier región del espectro electromagnético, desde las ondas de radio hasta los rayos gamma.
La incapacidad de las leyes clásicas –mecánicas o electromagnéticas– para interpretar los espectros emitidos por los átomos incandescentes, ¿no era acaso un índice de la invalidez de esas leyes en el interior del átomo? Plantear la cuestión era afirmar el hecho. El modelo de Rutherford había asimilado el átomo a un sistema planetario; Bohr tuvo el coraje de introducir el cuanto elemental de Planck, la constante h, y adoptar postulados cuya justificación sería su extraordinario éxito. Cualquier órbita planetaria es concebible en torno del Sol, pero los electrones planetarios en tomo del núcleo solamente pueden recorrer determinadas órbitas, cuyos radios son entre ellos como los cuadrados de los números enteros. Sólo están permitidas las órbitas que satisfacen como condición que el momento de la cantidad de movimiento del electrón con respecto al núcleo, m v r, multiplicado por 2, sea igual a un número entero de cuanto h, 2h, 3h, y así sucesivamente. Las demás trayectorias quedarán vedadas al electrón, que solamente puede elegir las prescritas por la condición cuántica de Bohr.
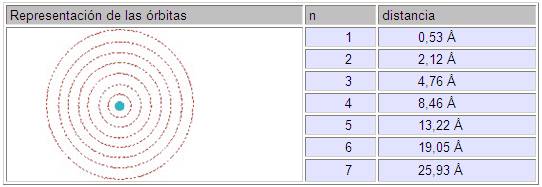
Bohr para desarrollar su modelo atómico utilizó el átomo de hidrógeno. Describió el átomo de hidrógeno con un protón en el núcleo, y girando a su alrededor un electrón.
En éste modelo los electrones giran en órbitas circulares alrededor del núcleo; ocupando la órbita de menor energía posible, o sea la órbita más cercana posible al núcleo.
Cada órbita se corresponde con un nivel energético que recibe el nombre de «número cuántico principal», se representa con la letra "n"; y toma valores desde 1 hasta 7.
De acuerdo al número cuántico principal calculó las distancias a las cuales se hallaba cada una de las órbitas permitidas en el átomo de hidrógeno, respecto del núcleo.
Números cuánticos
Los números cuánticos se empleen para describir matemáticamente un modelo tridimensional del átomo. El número cuántico principal, n, define el estado de energía principal, o capa, de un electrón en órbita. El número cuántico orbital, l, describe la magnitud del momento angular del electrón en órbita. El número cuántico m describe la orientación magnética en el espacio del plano de la órbita del electrón. El llamado espín se designa con el número cuántico de espín magnético, ms, que puede adoptar el valor de – 1 o + 1 según la dirección del espín. Para cada número cuántico, salvo ms, sólo están permitidos determinados valores enteros.
Los números cuánticos son cuatro:
Ø Número cuántico principal, n: Se relaciona con la distancia promedio que va del electrón al núcleo de un orbital en particular. Toma valores de los números enteros positivos y representa los niveles de energía de loa electrones de un átomo. Estos niveles aumentan de tamaño a medida que nos alejamos del núcleo. Posee valores n=1, 2, 3, 4, 5, 6,...
Ø Número cuántico secundario, azimutal o de momento regular, 1: Esta relacionado con la forma del orbital y depende del valor del número cuántico principal. Representa la existencia de subniveles de energía dentro de cada nivel. Se calcula considerando l = 0, 1, 2, 3, 4 Así, para n=1...l =0 ( "s" )para n=2 .........l = 0, 1 ( "s", "p" )para n=3 .........l = 0, 1, 2 ( "s", "p", "d" )para n=4 .........l = 0, 1, 2, 3, 4 ("s", "p", "d", "f" )
Los subniveles se designan con letras.
Ø Número cuántico magnético, m: Esta relacionado con la orientación espacial del orbital y depende del número cuántico de momento angular. Representa la orientación de los orbitales y se calcula m=+/- lsi l = 0, m=0 es decir 1 solo tipo de orbital ssi l = 1, m =-1, 0, +1 es decir 3 tipos de suborbitales p (px, py y pz)si l = 2, m = -2, -1, 0, +1, +2 es decir 5 tipos de suborbitales d (du, dv, dx, dy, dz)si l = 3, m = -3, -2, -1, 0, +1, +2, +3 es decir 7 tipos de suborbitales f (fs, ft, fu, fv, fx, fy y fz)
Un orbital puede albergar como máximo dos electrones.
Ø Número cuántico de spin electrónico, s: Determínale spin del electrón, es decir, el sentido en que gira el electrón sobre su propio eje.
Es decir, este numero cuantico indica la cantidad de electrones presentes en un orbital y el tipo de giro de los electrones, habiendo dos tipos +1/2 y -1/2. En cada tipo de suborbital cabe maximo 2 electrones y estos deben tener spines o girpos opuestos.
El principio de exclusión de Pauli indica que en un mismo átomo no pueden existir dos electrones que tengan los cuatro números cuánticos iguales, es decir que al menos un número cuántico debe ser distinto.
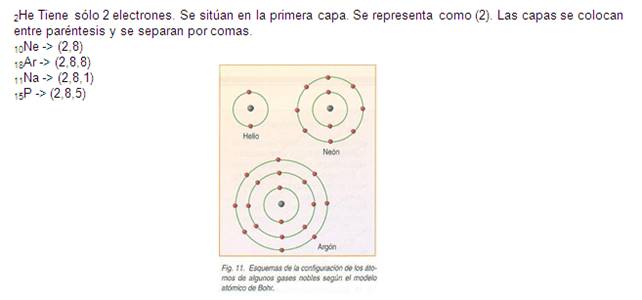
Según el modelo atómico de Bohr, y teniendo en cuenta lo recién explicado, podemos determinar que:
- En la primera capa (o nivel) se sitúan, como máximo, 2 electrones.
- En la segunda capa (o nivel) se sitúan, como máximo, 8 electrones.
- En la tercera capa (o nivel) se sitúan, como máximo, 18 electrones.
Ejemplos:
A los electrones que están situados en la última capa se les denomina electrones de valencia y, al nivel que ocupan, capa de valencia. Estos electrones son los responsables de las propiedades químicas de las sustancias.
Otros números cuánticos:
Número cuántico del momento angular ó azimutal ó secundario : "l"
- El valor mínimo de la n es 1, este valor corresponde a un mínimo radio de la orbita del electrón de 0,0529 nm. A esta distancia se la denomina radio de Bohr.
- Un electrón en este nivel fundamental no puede descender a niveles inferiores emitiendo energía, es decir que deja de denominarse radio de Bohr.
- Depende de "n" y toma valores enteros de 0 a (n-1). Así para n=1 sólo hay un valor posible 0. Para n=2 hay dos valores de l: 0 y 1. Para n=3 hay tres valores posibles: 0, 1 y 2.
- Generalmente el valor de l se representa por una letra en vez de por su valor numérico:
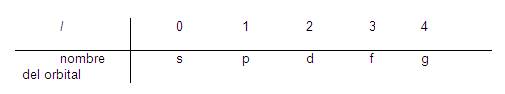
SE LOS RECONOCE CON ESTAS LETRAS PORQUE CADA UNA TIENE UN SIGNIFICADO EN INGLES:
S:SHARP
P:PRINCIPAL
D:DIFFUSE
F:FUNDAMENTAL
El número cuántico magnético "ml"
- El valor del número cuántico magnético depende de l . Toma valores enteros entre -l y l , incluyendo el 0. Para cierto valor l hay (2 l +1) valores de ml
- Describe la orientación del orbital en el espacio.
Por su parte, el electrón circula sobre esas órbitas, no radia ni pierde energía, de manera que su estado permanece estable. Cada órbita corresponde a un nivel determinado de energía, siendo el estado estable de menor energía la trayectoria más próximo al núcleo. Si el átomo recibe luz de una fuente exterior, la energía absorbida llevará al electrón a una órbita más alejada del núcleo. En el interior atómico, ganancia o pérdida de energía se traducen, pues, por saltos electrónicos que se efectúan, en el primer caso, hacia los niveles superiores; en el segundo, hacia los inferiores. El sentido de la ley Balmeres la diferencia entre la energía que caracteriza la órbita de partida y la de llegada, la que es irradiada por el átomo. Al dividir por h las energías de las órbitas estables del átomo de hidrógeno, se obtienen los términos espectrales, y el principio de combinación se encuentra interpretado. También la constante de Rydberg –medida desde hace mucho tiempo, pero refractaria a toda deducción teórica– se vuelve, a priori, calculable: la masa y carga del electrón y la constante de Planck conducen a su valor numérico.
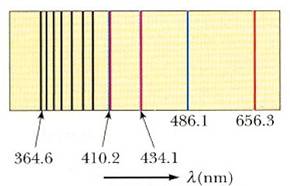
En el modelo de átomo de Bohr, cada órbita electrónica está caracterizada por un número cuántico, siendo la más próxima al núcleo aquélla con un cuanto, la órbita K, seguida por la de dos quantum, llamada L, y así sucesivamente. Si el electrón salta de una de las órbitas exteriores a la órbita L, el átomo irradia las líneas espectrales de la serie Balmer, que cruzan la parte visible del espectro del hidrógeno. Según la proveniencia del electrón saltarín, las cantidades de energía irradiadas, y con ellas la frecuencia (color) de la línea, serán diferentes: la línea roja de esta serie es el producto de un salto procedente de la órbita M; la línea azul, de uno desde la órbita N, y así sucesivamente. De manera análoga, otras series reciben también su explicación: la de Lyman, en el ultravioleta, corresponde a saltos electrónicos a la órbita K; la de Parchen, en el infrarrojo, a saltos a la órbita M. En todos los casos, las series están determinadas por la órbita de llegada; las líneas dentro de una serie, por la órbita de partida del electrón saltarín.
Concepto de órbita y orbital
Órbita es el recorrido (trayectoria) que traza un cuerpo en el espacio físico con el transcurso del tiempo con respecto a otro, generalmente este movimiento es sobre una curva cerrada y el movimiento es periódico, por ejemplo la curva que describe la Luna dando vueltas alrededor de la Tierra. Es un camino bien definido.
En el caso de un orbital, es algo parecido pero para el movimiento de los electrones en un sistema molecular (atómico). No es una órbita definida puesto que por el Principio de Incertidumbre de Heisenberg, la velocidad y la posición no pueden ser simultáneamente definidas. En Química Cuántica se utiliza el concepto de orbital para referirse a la función que describe el estado de un electrón que junto con las otras funciones (espín-orbitales) de los otros electrones forman una "superfunción" que viene siendo la solución a la ecuación de Schrödinger del sistema molecular (atómico) en cuestión. La solución es conocida como función de onda. El espín es para cumplir con el Principio de Exclusión de Pauli.En realidad orbital corresponde a un espacio matemático que ayuda a la resolución de la ecuación de Schrödinger y no a un espacio físico puesto que la función de onda no tiene sentido físico, sino esa función elevada al cuadrado que representa la probabilidad de encontrar al electrón en cierto lugar (densidad electrónica).
Representación de los niveles energéticos del átomo de hidrógeno
(Elemento que utlizo Bohr para detallar, ejemplificar, y explicar su teoría)
Los niveles energéticos del hidrógeno pueden calcularse con bastante precisión empleando el modelo atómico de Bohr. Sin embargo, la fuerza electromagnética hace que el protón y el electrón se atraigan, de igual modo que los planetas y otros cuerpos celestes se atraen por la fuerza gravitatoria. Debido al carácter discreto (cuantizado) del momento angular postulado en los inicios de la Mecánica Cuántica por Bohr, el electrón en el modelo de Bohr sólo puede orbitar a ciertas distancias permitidas alrededor del protón y, por extensión, con ciertos valores de energía permitidos. Una descripción más precisa del átomo de hidrógeno viene dada mediante un tratamiento puramente mecano - cuántico que emplea la ecuación de onda de Schrödinger o la formulación equivalente de las integrales de camino de Feynman para calcular la densidad de probabilidad del electrón. El tratamiento del electrón a través de la hipótesis de Broglie (dualidad onda - partícula) reproduce resultados químicos (tales como la configuración del átomo de hidrógeno) de manera más natural que el modelo de partículas de Bohr, aunque la energía y los resultados espectrales son los mismos. Si en la construcción del modelo se emplea la masa reducida del núcleo y del electrón (como se haría en el problema de dos cuerpos en Mecánica Clásica), se obtiene una mejor formulación para los espectros del hidrógeno, y los desplazamientos espectrales correctos para el deuterio y el tritio. Pequeños ajustes en los niveles energéticos del átomo de hidrógeno, que corresponden a efectos espectrales reales, pueden determinarse usando la Teoría Mecano - Cuántica completa, que corrige los efectos de la Relatividad Especial (ver ecuación de Dirac), y computando los efectos cuánticos originados por la producción de partículas virtuales en el vacío y como resultado de los campos eléctricos (ver Electrodinámica Cuántica).
Su aplicación, por ejemplo, la vemos en el siguiente ejercicio:
Calcular la longitud de onda de un fotón emitido por un átomo de hidrógeno, cuando su electrón desciende del nivel n=3 al nivel n=2.
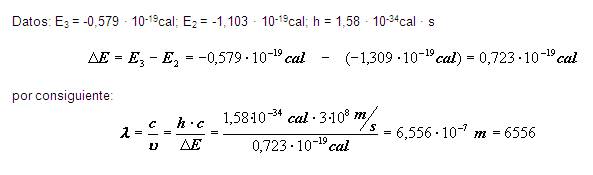
LÍNEAS ESPECTRALES DEL ÁTOMO DE HIDRÓGENO
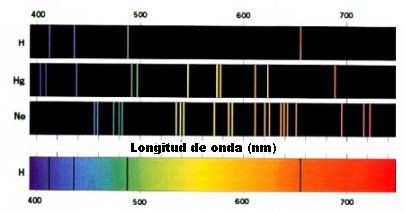
Los átomos de gases calientes emiten y absorben luz a ciertas longitudes de onda.
En el gráfico de arriba, se demuestran tres espectros de emisión y uno de absorción.
En 1885 Johann Balmer descubrió una ecuación que describe la emisión y absorción del espectro del átomo de hidrógeno
Biografia de Niels Bohr
Fisico danés, que hizo aportaciones fundamentales en el campo de la física nuclear y en el de la estructura atómica. Era hijo de un profesor de fisiología y estudió en la universidad de su ciudad natal, donde alcanzó el doctorado en 1911. Ese mismo año fue a la Universidad de Cambridge (Inglaterra) para estudiar física nuclear con J.J. Thomson, pero pronto se trasladó a la Universidad de Manchester para trabajar con Ernest Rutherford.
La teoría de la estructura atómica de Bohr, que le valió el Premio Nobel de Física en 1922, se publicó en una memoria entre 1913 y 1915. Su trabajo giró sobre el modelo nuclear del átomo de Rutherford, en el que el átomo se ve como un núcleo compacto rodeado por un enjambre de electrones más ligeros. El modelo de átomo de Bohr utilizó la teoría cuántica y la constante de Planck. El modelo de Bohr establece que un átomo emite radiación electromagnética sólo cuando un electrón del átomo salta de un nivel cuántico a otro. Este modelo contribuyó enormemente al desarrollo de la física atómica teórica.
En 1916, Bohr regresó a la Universidad de Copenhague como profesor de física, y en 1920 fue nombrado director del Instituto de Física Teórica de esa universidad, recién constituido. Allí, Bohr elaboró una teoría que relaciona los números cuánticos de los átomos con los grandes sistemas que siguen las leyes clásicas, y realizó otras importantes aportaciones a la física teórica. Su trabajo ayudó a impulsar el concepto de que los electrones se encuentran en capas y que los de la última capa determinan las propiedades químicas de un átomo.

No hay comentarios:
Publicar un comentario