A comienzos del siglo XX se
descubrió que no todos los átomos de un mismo elemento tenían la misma masa. Es
decir, el número de neutrones puede variar para átomos del mismo
elemento.
Los isótopos son
átomos de un mismo elemento que tienen igual número atómico, pero distintos
números másicos. Es decir, tienen el mismo número de protones pero distinto
número de neutrones.
Ejemplo: El elemento
hidrógeno, cuyo número atómico es 1 (es decir, que posee un protón en el
núcleo), tiene 3 isótopos en cuyos núcleos existen 0, 1 y 2 neutrones,
respectivamente.
En esta
página puedes consultar más información sobre isótopos.
La masa atómica relativa de
un elemento es la que corresponde a uno de sus átomos y equivale prácticamente a
la suma de las masas de sus protones y neutrones, ya que la de los electrones es
tan pequeña que puede despreciarse. Así, la mayor parte de la masa del átomo se
encuentra en el núcleo.
Como la unidad de masa en el
SI, el kilogramo, es demasiado grande se ha buscado una unidad del tamaño de los
átomos de la siguiente forma:
- Se ha escogido el átomo de
carbono-12 (12C) como átomo de referencia.
- Se le ha asignado una masa
de 12 u.m.a. (unidades de masa atómica), ya que tiene 6 protones y 6
neutrones.
- La unidad de masa atómica
(uma) es la 1/12 parte de la masa del átomo de carbono-12.
La masa de un átomo medida
por comparación con la masa del carbono-12 se llama masa atómica. Se
encuentra recogida en la tabla periódica su valor para cada elemento.
En esta página puedes ver las masas atómicas (en uma) de todos los
elementos de la tabla periódica.
5.1.- Isótopos y masa
atómica
Como hemos visto, no todos
los átomos de un mismo elemento son exactamente iguales. La mayoría de los
elementos tienen diferentes isótopos y esto hay que tenerlo en cuenta para
calcular la masa atómica.
La masa atómica de un
elemento es la media ponderada de sus isótopos (Por eso, la masa atómica
de un elemento no es un número entero).
Ejemplo: El cloro tiene 2
isótopos, 3517Cl y 3717Cl, que se presentan en la naturaleza con una abundancia
del 75,5 % y del 24,5 %, respectivamente.
La masa atómica del cloro
será la media ponderada: 35 · 75,5/100 + 37 · 24,5/100 = 35,5
uma.
6.- Nuevos hechos, nuevos modelos
El modelo atómico de
Rutherford era incapaz de explicar ciertos hechos:
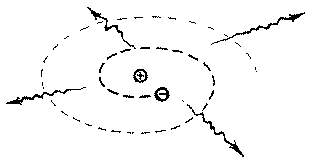
- La carga negativa del
electrón en movimiento iría perdiendo energía hasta caer contra el núcleo y esto
haría que los átomos fuesen inestables.
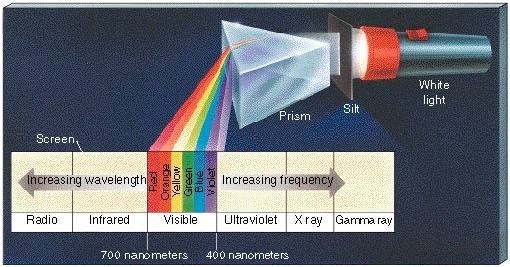
- Al hacer pasar radiación
visible por un prisma, la luz se descompone en los colores del arco iris, esto
se conoce como espectro continuo de la luz visible:
Pues bien, la luz que emiten
los átomos de los elementos dan lugar a espectros discontínuos:
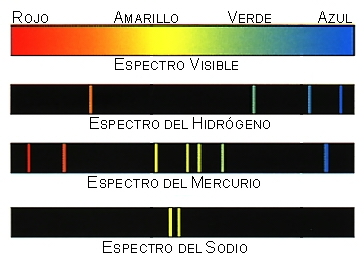
El hecho de que cada átomo
tenga un espectro de rayas distinto y discontinuo debe estar relacionado con su
estructura. Esto no se podía explicar con el modelo de Rutherford.

No hay comentarios:
Publicar un comentario